ผู้จัดจำหน่ายและนำเข้า อุปกรณ์ทางวิทยาศาสตร์ อุปกรณ์ห้องแลป และสื่อการเรียนการสอน
49th Anniversary
การทดลองการละลายของ สารประกอบไอออนิกในน้ำ
จุดประสงค์การทดลอง
1. ทำการทดลองเพื่อศึกษาการเปลี่ยนแปลงพลังงานเมื่อสารประกอบไอออนิกละลายในนํ้าได้
2. อธิบายการเปลี่ยนแปลงพลังงานเมื่อสารประกอบไอออนิกละลายในนํ้า
สารเคมีและอุปกรณ์
| รหัสสินค้า | รายการ |
| 3091270 | คอปเปอร์ (II) ซัลเฟต (จุนสี) 450 กรัม |
| 3090095 | แอมโมเนียมคลอไรด์ 450 กรัม |
| 3097085 | โซเดียมคลอไรด์ 450 กรัม |
| 3016150 | แท่งแก้วคนสาร (10 อัน/ชุด) |
| 3014540 | ช้อนตักสารเบอร์ 1 |
| 2012041 | แคลอริมิเตอร์ |
| 30Y221 | เทอร์มอมิเตอร์แอลกอฮอล์ -20 -110 °C (ALLA France) |
| 30102032 | โกร่งและที่บด |
| 86406170150 | กระบอกตวงขนาด 50 มล. |
| 30160653 | ถ้วยกระเบื้อง 60 ซีซี (75มม.) |
วิธีการทดลอง
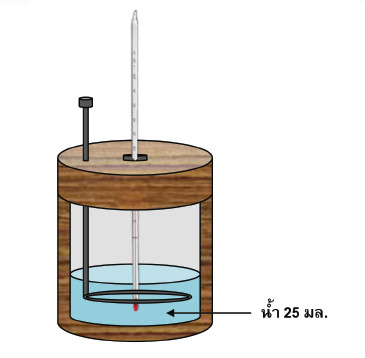 1. บรรจุนํ้า 25 มล. ไว้ในแคลอริมิเตอร์ วัดอุณหภูมิของนํ้าและบันทึกผล ดังรูป
1. บรรจุนํ้า 25 มล. ไว้ในแคลอริมิเตอร์ วัดอุณหภูมิของนํ้าและบันทึกผล ดังรูป
2. ใส่คอปเปอร์ (II) ซัลเฟตที่ปราศจากนํ้า 1 กรัม ลงในนํ้าที่เตรียมไว้ คนสารให้ละลายแล้วรีบปิดฝา บันทึกวัดอุณหภูมิสูงสุดหรือตํ่าสุดของ สารละลายที่เปลี่ยนแปลง
3. ทำการทดลองเช่นเดียวกับข้อ 1-2 แต่ใช้แอมโมเนียมคลอไรด์ (NH4CI) และ โซเดียมคลอไรด์ (NaCI) แทน
ตัวอย่างผลการทดลอง
| สาร | มวลของสาร (g) | อุณหภูมิของนํ้า (°C) | อุณหภูมิของสารละลาย (°C) |
| 1. CuSO4 | 1 | 31.0 | 35.0 |
| 2. NH4Cl | 1 | 31.0 | 29.0 |
| 3. NaCl | 1 | 31.0 | 30.5 |
อภิปรายผลการทดลอง
สารทั้งสามชนิดมีความสามารถในการละลายในนํ้าได้แตกต่างกันและอุณหภูมิของสารละลายมีการเปลี่ยนแปลงเนื่องจากมีพลังงานเกิดขึ้น รายละเอียดดังนี้
• CuSO4 ที่ปราศจากนํ้า มีความสามารถในการละลายในนํ้าได้ช้า มีการเปลี่ยนแปลงประเภทคายพลังงาน เพราะอุณหภูมิของสารละลายสูงขึ้น
• NH4Cl สามารถละลายในนํ้าได้อย่างรวดเร็ว มีการเปลี่ยนแปลงประเภทดูดพลังงาน เพราะอุณหภูมิของสารละลายลดลง
• NaCl สามารถละลายในนํ้าได้ดี การเปลี่ยนพลังงานน้อยมาก เพราะอุณหภูมิของสารละลายเกือบคงที่นอกจากนี้ขั้นตอนในการเกิดสารละลายของสารประกอบไอออนิกและพลังงานเกี่ยวข้องกับการละลายของสาร โดยสามารถแสดงได้ตามแผนภาพแสดงการเปลี่ยนแปลงพลังงานในกระบวนการเกิดสารละลายแอมโมเนียมคลอไรด์ (NH4Cl) ซึ่งเป็นผลของอุณหภูมิที่มีต่อการละลายของสารละลายไอออนิก ดังนี้
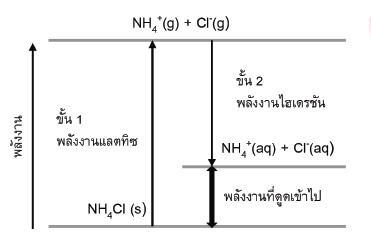
รูปที่ 1 การเปลี่ยนแปลงพลังงานในการเกิดสารละลายแอมโมเนียมคลอไรด์
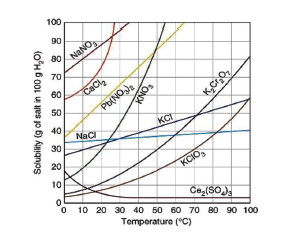
รูปที่ 2 การละลายของสารประกอบไอออนิกบางชนิดที่อุณหภูมิต่าง ๆ
อุณหภูมิเป็นปัจจัยสำคัญอย่างหนึ่งที่มีผลต่อการละลายของสาร สารที่ละลายในตัวทำละลายได้มากขึ้นเมื่ออุณหภูมิของสารละลายสูงขึ้นจะมีขั้นตอนการละลายเป็นแบบดูดพลังงาน เช่น NH4NO3 ส่วนสารที่ละลายในตัวทำละลายได้น้อยลงเมื่ออุณหภูมิของสารละลายเพิ่มขึ้นจะมีขั้นตอนในการละลายเป็นแบบคายพลังงาน เช่น Ce2(SO4)3 กราฟแสดงการละลายของสารประกอบไอออนิกบางชนิดที่อุณหภูมิต่าง ๆ ดังรูปที่ 2
ข้อแนะนำเพิ่มเติม
• เตรียมคอปเปอร์ (II) ซัลเฟตที่ปราศจากนํ้า โดยนำคอปเปอร์ (II) ซัลเฟต หรือจุนสี (CuSO4•5H2O) บดละเอียดแล้วนำไปเผาด้วยไฟอ่อน ๆ ในถ้วยกระเบื้อง คนตลอดเวลาเพื่อป้องกันการประทุ เมื่อนํ้าระเหยออกหมดจะได้ผงสีขาวของคอปเปอร์ (II)ซัลเฟตที่ปราศจากนํ้า (CuSO4) เก็บในขวดที่แห้งสนิทตั้งไว้ให้เย็นแล้วปิดฝาให้สนิทเพื่อป้องกันความชื้นจากภายนอก
• เช็ดแคลอริมิเตอร์ให้แห้งก่อนทำการทดลองทุกครั้ง
• เมื่อละลายสารในนํ้าแล้วอ่านอุณหภูมิจากเทอร์มอมิเตอร์ตลอดเวลาจนอุณหภูมิไม่เปลี่ยนแปลง และบันทึกอุณหภูมิที่เพิ่มขึ้นไปสูงที่สุดหรือลดตํ่าที่สุด
• เมื่อละลายโซเดียมคลอไรด์ อุณหภูมิของสารละลายมีการเปลี่ยนแปลงน้อยมากจนอาจทำให้สังเกตเห็นว่าไม่มีการเปลี่ยนแปลง เนื่องจากมีพลังงานไฮเดรชั่นสูงกว่าพลังงานแลตทิชเล็กน้อย จึงทำให้อุณหภูมิสารละลายสูงขึ้นเล็กน้อย ดังรูปที่ 3
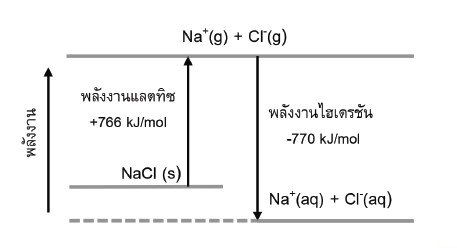
รูปที่ 3 การเปลี่ยนแปลงพลังงานในการเกิดสารละลายโซเดียมคลอไรด์



