ผู้จัดจำหน่ายและนำเข้า อุปกรณ์ทางวิทยาศาสตร์ อุปกรณ์ห้องแลป และสื่อการเรียนการสอน
49th Anniversary
การทดลองสีของเปลวไฟ และเส้นสเปคตรัมของธาตุบางชนิด
จุดประสงค์การทดลอง
1.ทำการทดลองเพื่อศึกษาสีของเปลวไฟของธาตุในสารประกอบและเส้นสเปกตรัมของธาตุบางชนิดได้
2.ระบุได้ว่าสีของเปลวไฟเกิดจากองค์ประกอบส่วนใดของสารประกอบ
3.บอกสีของเปลวไฟของธาตุได้
4.บอกความแตกต่างระหว่างสเปกตรัมของแสงจากดวงอาทิตย์กับแสงจากหลอดฟลูออเรสเซนต์ได้
5.บอกความแตกต่างของเส้นสเปกตรัมของธาตุที่นำมาทดสอบได้
สารเคมีและอุปกรณ์
สารเคมี
3092176 กรดไฮโดรคลอริค เข้มข้น 12 โมล 450 ซีซี
3097085 โซเดียมคลอไรด์ 450 กรัม
3091020 แบเรียมไนเตรด 100 กรัม
3091010 แบเรียมคลอไรด์ 450 กรัม
3091110 แคลเซียมคลอไรด์ 350 กรัม
3091145 แคลเซียมซัลเฟต 450 กรัม
3091240 คอปเปอร์ (II) คาร์บอเนต 100 กรัม
3091270 คอปเปอร์ (II) ซัลเฟต (จุนสี) 450 กรัม
อุปกรณ์
7018100 ลวดนิโครมเบอร์ 26 ยาว 100 ซม. (10 เส้น/ชุด)
3015115 ตะเกียงแอลกอฮอล์สแตนเลส
3016085 ที่กั้นลม-ที่วางตะแกรงลวด
20EP624 Diffraction Grating, 100, 300, 600
862060113100 หลอดทดลอง 13x100 มม.
2014529 ชุดสเปกตรัมกล่องไม้พร้อมหลอด 3 หลอด (หลอดบรรจุแก๊สไฮโดรเจน แก๊สนีออน ไอปรอท)
2019252 หม้อแปลงโวลท์ตํ่า AC/DC
862020890 กระจกนาฬิกา 90 มม.
8620201100 บีคเกอร์ 100 มล.
3014546 ช้อนพลาสติกเบอร์ 1-2 (10 อัน/ชุด)
30151901 ตารางธาตุ 85x180 ซม.
ตัวอย่างผลการทดลอง
ตอนที่ 1
เมื่อเผาสารประกอบตามที่กำหนดให้จะได้ผลดังตาราง
| สารที่ใช้ | สีของเปลวไฟ |
| โซเดียมคลอไรด์ | สีเหลือง |
| แบเรียมไนเตรต | สีเขียวแกมเหลือง |
| แคลเซียมคลอไรด์ | สีเขียวแกมเหลือง |
| แคลเซียมเฟต | สีแดงอิฐ |
| คอปเปอร์ (II) คาร์บอเนต | สีแดงอิฐ |
| คอปเปอร์ (II) คาร์บอเนต | สีเขียว |
| คอปเปอร์ (II) ซัลเฟต | สีเขียว |

รูปที่ 1 ตัวอย่างสีของเปลวไฟธาตุ Ca, Na, และ Ba
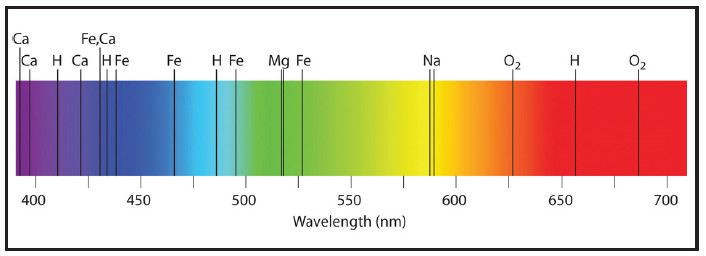
รูปที่ 2 สเปกตรัมของธาตุต่าง ๆ ในช่วง visible light
ตอนที่ 2
เมื่อใช้แผ่นเกรตติ้งส่องดูแสงขาวจากดวงอาทิตย์จะมองเห็นแถมสีต่าง ๆ ต่อเนื่องกัน แต่เมื่อส่องดูแสงจากหลอดฟลูออเรสเซนต์นอกจากจะเห็นแถบสีที่ต่อเนื่องกันแล้วยังพบเส้นสีบางเส้น เช่น เส้นสีเหลืองบนแถบสีเหลือง หรือเส้นสีเขียวบนแถบสีเขียวอีกด้วย
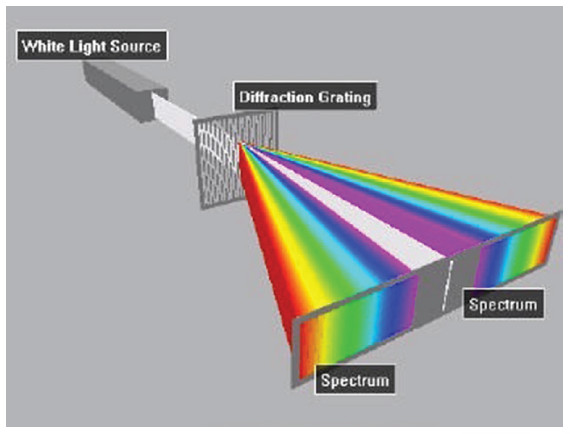
รูปที่ 3 จำลองการเลี้ยวเบนของแสงขาวผ่านเกรตติ้ง

รูปที่ 4 ตัวอย่างสเปกตรัมที่ได้จากการเลี้ยวเบนของแหล่งกำเนิดแสงต่าง ๆ
อภิปรายการทดลอง
เมื่อทำการทดลองเสร็จแล้วสำหรับการทดลองทั้ง 2 ตอน เพื่อให้ได้ข้อสรุป ดังนี้
1. สีของเปลวไฟที่เกิดจากการเผาสารประกอบ เกิดจากธาตุองค์ประกอบที่เป็นโลหะ
2. เส้นสีบางเส้นที่พบบนแถบสเปกตรัมของแสงจากหลอดฟลูออเรสเซนต์ เป็นสเปกตรัมของสารเรืองแสงที่ฉาบอยู่ภายในหลอด
3. ธาตุแต่ละชนิดจะให้ชุดของสเปกตรัมไม่เหมือนกัน ซึ่งเป็นสมบัติเฉพาะตัวประการหนึ่งที่นำมาใช้ตรวจหาธาตุองค์ประกอบของสารได้ โดยการเปรียบเทียบกับเส้นสเปกตรัมของธาตุต่าง ๆ
ความรู้เกี่ยกับการศึกษาสเปกตรัมของอะตอมไฮโดรเจน สามารถนำไปสร้างแบบจำลองอะตอม และสีของเส้นสเปกตรัมจะบอกถึงค่าพลังงานของเส้นสเปกตรัมนั้นด้วย ทั้งนี้เพราะเส้นสเปกตรัมเกิดจากการคายพลังงานของอิเล็กตรอนเมื่อมีการเปลี่ยนระดับชั้นพลังงาน การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำเป็นต้องเปลี่ยนทีละระดับแต่สามารถเปลี่ยนทีละหลายระดับได้ ถ้าเปลี่ยนหลายระดับ ค่าพลังงานของสเปกตรัมที่ปรากฏก็จะสูงตามไปด้วย
ข้อแนะนำเพิ่มเติม
1. การใช้กรดเข้มข้นต้องระมัดระวังมาก ๆ โดยเฉพาะกรดโฮโดรคลอริกซึ่งระเหยเป็นไอได้ง่าย เมื่อเทใส่บีกเกอร์แล้วต้องปิดด้วยกระจกนาฬิกาตลอกเวลาและเปิดเฉพาะเมื่อต้องการใช้เท่านั้น
2. ล้างลวดนิโครมทุกครั้งก่อนนำไปใช้เผาสารใหม่ และหลังจากเสร็จสิ้นการทดลอง
3. ควรใช้แผ่นเกรตติ้งส่องดูแสงขาวจากดวงอาทิตย์จนสามารถมองเห็นสเปกตรัมได้ก่อนนำไปใช้ส่องดูสเปกตรัมอื่น ๆ
4. ไม่ควรใช้แผ่นเกรตติ้งส่องดูดวงอาทิตย์โดยตรง เพราะจะมีผลเสียต่อดวงตาได้
5. การเผาสารในการทดลอง ถ้าต้องการให้สีเปลวไฟเกิดได้นาน อาจทำได้โดยนำสารที่จะทดสอบซึ่งบดละเอียดแล้วใส่ในถ้วยกระเบื้อง เติมนํ้าเล็กน้อยเพื่อละลายสาร เติมเอทานอลลงไปประมาณ 3 cm3 แล้วคนให้เข้ากัน จุดเอทานอลในถ้วยกระเบื้องและใช้แท่งแก้วคนสารตลอดเวลาสังเกตสีของเปลวไฟที่เกิดขึ้น
6. แผ่นเกรตติ้งทำหน้าที่เลี้ยวเบนแสงออกเป็นแสงที่มีความถี่ต่าง ๆ กันเช่นเดียวกับการหักเหของแสงผ่านปริซึม
อ้างอิง http://slideplayer.com/slide/4637590/15/images/31/Flame+Colors+Li+Na+K+Ca+Sr+Ba.jpg
https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/section_10/1c6d27a73443b05b3de40bc49186d18b.jpg
https://qph.fs.quoracdn.net/main-qimg-3c1a020f02966fffb13e72d8a8313d72-c
https://i1.wp.com/akron.makerfaire.com/wp-content/uploads/sites/120/gravity_forms/7-8054e9b1a7fd0dc05ae26abf039beb92/2017/10/Figure-4_v2-800x654.jpg?fit=750%2C500&strip=all



